Tout savoir sur le titrage
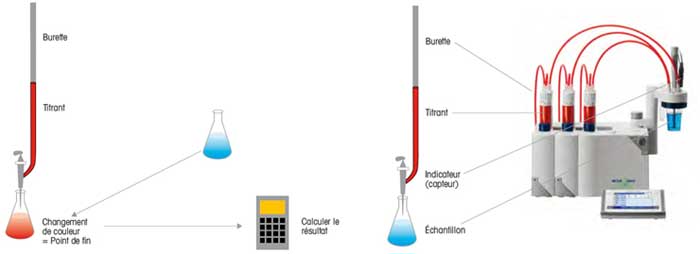
Le titrage est une méthode de détermination quantitative d'une liaison chimique dans un échantillon. Il se fait par l'ajout contrôlé d'un réactif (titrant) de concentration connue, à l'aide d'une burette en verre à robinet, d'un dispositif de dosage ou d'un titreur.
 |
||
agrandir les schémas |
La réaction chimique qui se produit alors entre l'assemblage (titrant) et le réactif doit être quantitative, sélective et rapide et obéir à une stoechiométrie simple. Il est, en outre, essentiel que le point final de la réaction soit reconnaissable de manière univoque. Cela peut, par exemple, être réalisé à l'aide d'un indicateur qui signale la fin de la réaction par un changement de couleur.
Plusieurs techniques peuvent être utilisées pour déterminer le titrage en point final (EP)ou le titrage au point d'équivalence (EQP)
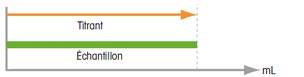
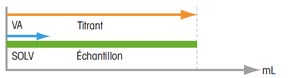
Titrage direct Il n'est possible que dans un solvant inerte. La condition nécessaire, en outre, est que la réaction se déroule vite et que le point final du titrage puisse être reconnu sans ambiguïté. En présence d'un solvant non inerte, il faut commencer par déterminer sa valeur à blanc, avant d'ajouter l'échantillon à analyser. La teneur réelle d'un échantillon s'obtient donc en déduisant la valeur à blanc déterminée. |
||
 |
 |
|
| Résultat = titrant utilisé | Résultat = titrant utilisé - valeur à blanc | |
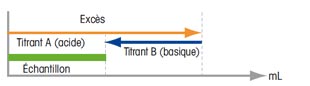
Titrage en retour On utilise cette méthode quand la mise en oeuvre est trop lente et/ou que le point final ne peut pas être déterminé de manière univoque. On apporte alors un excès en titrant A à l'échantillon dissous, puis on titre l'excès avec un titrant B jusqu'au titrage de point final/point d'équivalence (EP/EQP). |
||
 |
||
| Résultat = excès - titrant B utilisé | ||
Les types de réaction pour le titrage : lire la suite
| Demande d'information |
